










الکل آزمایشگاهی
الکل آزمایشگاه را می توان به عنوان مشتقات هیدروکربن ها که در آنهایک هیدروژن به وسیله گروه هیدروکسیل ، OH، جانشین شده است ، در نظر گرفت. گروه هیدروکسیل یکی از چندین گروه های عاملی است. گروه عاملی گروهی از اتمهاست که به ترکیبات آلی حامل آن خواص شیمیایی و فیزیکی ویژه می بخشد.
اکثر الکل آزمایشگاهی مایعات یا جامدات بی رنگ در دمای اتاق هستند. الکل های با وزن مولکولی پایین بسیار محلول در آب هستند. با افزایش وزن مولکولی، آنها کمتر در آب حل می شوند و نقطه جوش ، فشار بخار ، چگالی و ویسکوزیته آنها افزایش می یابد.
الکل آزمایشگاهی را به صورت مشتقات هیدروکربنی که در طویل ترین زنجیر راست خود حاوی گروه OH است نامگذاری می کنند. پسوند هیدروکربن مادر از-ان به-انول تغییرداده میشود و برای مشخص کردن موقعیت گروه های استخلافی از شماره استفاده می کنند به طوری که کوچکترین شماره ممکن به گروه OH تخصیص یابد.
قیمت الکل
الکل را ممکن است بر حسب تعداد بنیانهای آلکیل موجود بر روی اتم کربن ای که حامل OH است دست به صورت نوع اول ، نوع دوم ، نوع سوم طبقه بندی کرد که بر اساس آن کربن گروه آلکیل به گروه هیدروکسیل متصل میشود.
مشابه آب، یک الکل را می توان به عنوان دارای یک اتم اکسیژن چهاروجهی هیبرید شده s p 3 با جفت الکترون های غیر پیوندی که دو اوربیتال از چهار اوربیتال هیبریدی s p 3 را اشغال می کند، تصویر کرد. گروه های آلکیل عموماً حجیم تر از اتم های هیدروژن هستند، بنابراین R—O—H زاویه پیوند در الکل ها به طور کلی بزرگتر از زاویه پیوند 104.5 درجه H-O-H در آب است. به عنوان مثال، زاویه پیوند 108.9 درجه در متانول ، اثر گروه متیل را نشان میدهد که بزرگتر از اتم هیدروژن آب است.
الکل آزمایشگاه
یکی از راههای طبقهبندی الکلها این است که بر اساس کدام اتم کربن به گروه هیدروکسیل پیوند میخورد. اگر این کربن اولیه باشد (1 درجه، فقط به یک اتم کربن دیگر پیوند دارد)، ترکیب الکل اولیه است. الکل ثانویه دارای گروه هیدروکسیل بر روی یک اتم کربن ثانویه (2 درجه) است که به دو اتم کربن دیگر پیوند دارد. به همین ترتیب، الکل سوم دارای گروه هیدروکسیل بر روی یک اتم کربن سوم (3 درجه) است که به سه کربن دیگر پیوند دارد.
الکل
الکل ها از طریق تشکیل پیوند هیدروژنی با هم جمع می شود. به این دلیل نقاط ضعف و نقاط جوش الکل ها از آلکان ها که با آن الکل ها وزن مولکولی مشابه دارند بالاتر است. الکل های ردیف های پایین تر به خاطر تشکیل پیوند هیدروژنی بین مولکولی در هر نسبتی با آب امتزاج پذیرند.
ولی به تدریج که اندازه بنیان آلکیل افزایش می یابد الکل ها از نظر خواص فیزیکی بیشتر شبیه آلکان ها می شوند و الکل های ردیف های بالاتر فقط به مقدارکم در آب انحلال پذیرند.
الکل ها مانند آب اجسامی آمفی پروتیک اند و میتوانند در مقابل اسید های بسیار قوی به صورت بازبرونستد
H2SO4+ROH↔ROH2++HSO4-
و در مقابل بازهای قوی به صورت اسید برونستد عمل کنند.
الکل آزمایشگاهی
ROH+H-→OR-+H2 با وجود این ، الکل ها نسبت به آب از لحاظ قدرت اسیدی و بازی ضعیف ترند. در نتیجه ، اسیدهای مزدوج(ROH2+) و بازهای مزدوج (OR-) مربوطه ازH3O+ و OH- قویترند. آنیونOR- ، که به عنوان یون الکوکسید شناخته شده ، از واکنش یک الکل با یک فلز واکنش دهنده نتیجه می گیرد. اکثر الکل های رایج مایعات بی رنگ در دمای اتاق هستند. متیل الکل، اتیل الکل وایزوپروپیل الکل مایعاتی با جریان آزاد با بوی میوه هستند. الکل های بالاتر - آنهایی که حاوی 4 تا 10 اتم کربن هستند - تا حدودی چسبناک یا روغنی هستند و بوی میوه ای سنگین تری دارند. برخی از الکل های بسیار شاخه دار و بسیاری از الکل های حاوی بیش از 12 اتم کربن در دمای اتاق جامد هستند.
خواص فیزیکی الکل های انتخاب شده
نام IUPAC نام متداول فرمول mp (°C)
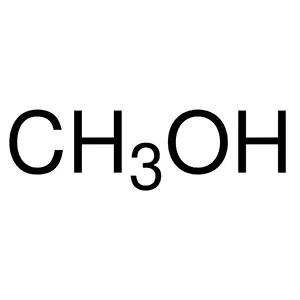
متانول متیل الکل CH 3 OH -97
اتانول الکل اتیلیک CH 3 CH 2 OH −114
1-پروپانول n-پروپیل الکل CH 3 CH 2 CH 2 OH -126
2-پروپانول ایزوپروپیل الکل (CH 3 ) 2 CHOH -89
1-بوتانول n- بوتیل الکل CH 3 (CH 2 ) 3 OH -90
۲-بوتانول ثانیه بوتیل الکل (CH3 ) CH(OH ) CH2 CH3 −114
2-متیل-1-پروپانول ایزوبوتیل الکل (CH 3 ) 2 CHCH 2 OH −108
2-متیل-2-پروپانول الکل تی بوتیل (CH 3 ) 3 COH 25
1-پنتانول n-پنتیل الکل CH 3 (CH 2 ) 4 OH -79
3-متیل-1-بوتانول ایزوپنتیل الکل (CH 3 ) 2 CHCH 2 CH 2 OH −117
2،2-دی متیل-1-پروپانول نئوپنتیل الکل (CH 3 ) 3 CCH 2 OH 52
سیکلوپنتانول سیکلوپنتیل الکل cyclo-C 5 H 9 OH -19
1-هگزانول n-هگزانول CH 3 (CH 2 ) 5 OH -52
سیکلوهگزانول سیکلوهگزیل الکل cyclo-C 6 H 11 OH 25
1-هپتانول n-هپتیل الکل CH 3 (CH 2 ) 6 OH -34
1-اکتانول n-اکتیل الکل CH 3 (CH 2 ) 7 OH -16
1-نونانول الکل n-نونیل CH 3 (CH 2 ) 8 OH -6
1-دکانول الکل n-دسیل CH 3 (CH 2 ) 9 OH 6
2-پروپن-1-اول آلیل الکل H 2 C = CH-CH 2 OH -129
فنیل متانول الکل بنزیل Ph−CH 2 OH* −15
دی فنیل متانول دی فنیل کاربینول Ph 2 CHOH* 69
تری فنیل متانول تری فنیل کاربینول Ph 3 COH* 162
نام IUPAC bp (°C) چگالی (گرم در میلی لیتر) حلالیت در آب
متانول 65 0.79 قابل اختلاط
اتانول 78 0.79 قابل اختلاط
1-پروپانول 97 0.80 قابل اختلاط
2-پروپانول 82 0.79 قابل اختلاط
1-بوتانول 118 0.81 9.1٪
۲-بوتانول 100 0.81 7.7٪
2-متیل-1-پروپانول 108 0.80 10.0٪
2-متیل-2-پروپانول 83 0.79 قابل اختلاط
1-پنتانول 138 0.82 2.7٪
3-متیل-1-بوتانول 132 0.81 2.0٪
2،2-دی متیل-1-پروپانول 113 0.81 3.5٪
سیکلوپنتانول 141 0.95
1-هگزانول 156 0.82 0.6٪
سیکلوهگزانول 162 0.96 3.6٪
1-هپتانول 176 0.82 0.1٪
1-اکتانول 194 0.83
1-نونانول 214 0.83
1-دکانول 233 0.83
2-پروپن-1-اول 97 0.86
فنیل متانول 205 1.05
دی فنیل متانول 298
تری فنیل متانول 380 1.20
*Ph نشان دهنده گروه فنیل، C 6 H 5 - است.
فروش الکل
آب و الکل ها دارای خواص مشابهی هستند زیرا مولکول های آب حاوی گروه های هیدروکسیل که می توانند با مولکول های دیگر آب و با مولکول های الکل پیوند هیدروژنی ایجاد کنند و به همین ترتیب مولکول های الکل می توانند با سایر مولکول های الکل و همچنین با آب پیوند هیدروژنی ایجاد کنند. از آنجایی که الکل ها با آب پیوند هیدروژنی تشکیل می دهند، تمایل به حل شدن نسبتاً در آب دارند. گروه هیدروکسیل به عنوان a نامیده می شود گروه آبدوست ("آب دوست")، زیرا با آب پیوندهای هیدروژنی ایجاد می کند و حلالیت الکل را در آب افزایش می دهد . متانول، اتانول، n- پروپیل الکل، ایزوپروپیل الکل، و الکل تی بوتیل همگی با آب قابل اختلاط هستند. الکل هایی با وزن مولکولی بالاتر معمولا کمتر در آب محلول هستند، زیرا بخش هیدروکربنی مولکول، که آبگریز ("متنفر از آب")، با افزایش وزن مولکولی بزرگتر است. از آنجایی که الکل ها به شدت قطبی هستند، حلال های بهتری نسبت به هیدروکربن ها برای ترکیبات یونی و سایر مواد قطبی هستند.
الکل های مهم تجاری
متانول
اولین عضو این مجموعه متانول یا متیل الکل ، به عنوان الکل چوب شناخته شده است زیرا می توان آن را از تقطیرتخریبی چوب به دست آورد. منبع عمده تجارت این الکل هیدروژن دار کردن کاتالیزوری کربن مونوکسید است.
مخلوط مونوکسید کربن و هیدروژن مورد نیاز برای ساخت متانول را می توان با سوزاندن جزئی زغال سنگ در حضور آب تولید کرد. با تنظیم دقیق مقدار آب اضافه شده، می توان نسبت صحیح مونوکسید کربن به هیدروژن را به دست آورد.
اتانول
الکل نوشابه های الکلی ، اتانول یا اتیل الکل است که به وسیله تخمیر نشاسته ها یا قند ها تهیه می شود. افزایش غیر مستقیم آب به اولفین ها به وسیله سولفوریک اسید ، یک روش کلی تهیه الکل هاست.
تخمیر یک روش نسبتاً گران برای ساخت اتانول است. اتانول صنعتی معمولاً با افزودن کاتالیزوری در دمای بالا به اتیلن (C 2 H 4 ) سنتز می شود.
سنتز الکل ها
الکل ها را می توان از آلکیل هالید ها به وسیله واکنش های جانشینی یا استخلافی هسته دوستی تهیه کرد. این یک طبقه مهم از واکنش های شیمیایی است که واکنش های آلکیل هالیدها و همچنین خود الکل ها را با انواع وسیعی از اجسام هست دوست در بر می گیرد. این واکنش ها معمولاً برگشت پذیرند و آنها را در شرایطی انجام میدهند که مناسب به تشکیل ترکیب مورد نظر باشد برای این منظور مقدار زیادی از واکنش گر هسته دوست به کار برده می شود و یا این که محصول را به تدریج که تشکیل می شود از مخلوط واکنش خارج می کنند مثلاً با تقطیر.
هالید ها با الکل های نوع اول و دوم از طریق مکانیسم SN2 (substitution nucleophilic bimolecular) که میتوان آن را به وسیله یون هیدروکسید با متیل برومید مجسم کرد ، ترکیب می شوند. یون هیدروکسید که یک باز لوئیس است به اتم کربن حمله می برد و جانشین یون برومید ( که آن هم یک باز لوئیس است ) می شود. یون برومید جفت الکترونی را که با آن به اتم کربن متصل بوده است به همراه می برد.
یون OH- به آن سمتی از اتم کربن حمل می برد که مقابل اتم برم است.همچنان که یون OH- به اتم کربن نزدیک می شود تشکیل یک پیوند کووالانسی را آغاز میکند ، و در همان حال یون برومید گسستن و جدا شدن از اتم کربن را شروع میکند.
کمپلکس فعال شده این واکنش شکلی است که در آن هر دو گروه هسته دوست به طور جزئی با اتم کربن پیوند دارد.این واکنش موجب وارونگی آرایش هندسه گروه های متصل به اتم کربن می گردد.این مکانیسم با علامت SN2 مشخص میشود زیرا شامل استخلاف یک گروه هست دوست به جای دیگری است و مرحله تعیین کننده سرعت هم دو مولکولی است.
درمورد آلکیل هالید های نوع سوم سه گروه آلکیلی که به اتم کربن حامل هالوژن متصلند مانع میشوند که یون OH- از پشت نزدیک شود و تصور می رود که آلکیل هالید های نوع سوم واکنش های جانشینی را به وسیله مکانیسم متفاوتی انجام میدهند. مرحله تعیین کننده سرعت در این مورد ممکن است تشکیل یک کربوکاتیون باشد.
کربوکاتیون اسید لوئیس قوی است و به سرعت با آب که به عنوان بازلوئیس عمل میکند واکنش میدهد:
این حد واسط یونی به سرعت یک پروتون از دست میدهد وبه الکل نوع سوم تبدیل می شود.
این مکانیسم با علامت SN1 مشخص میشود زیرا یک استخلاف هسته دوست است که در آن مرحله تعیین کننده سرعت یک مولکولی است. وقتی واکنش در حلال های قطبی مانند آب که یونش هالید را در مرحله اول یاری می دهد انجام بگیرد شرایط برای مکانیسم SN1 مساعد است.
درتمام واکنش های استخلافی هسته دوستی مقادیرقابل ملاحظهای ازاولفین هاهمراه بامحصولات استخلافی تشکیل میشوند.
کاربرد الکل ها
الکل ها از رایج ترین ترکیبات آلی هستند . آنها به عنوان شیرین کننده و در ساخت عطرها استفاده می شوند.
واسطه های ارزشمندی در سنتز سایر ترکیبات هستند و از جمله فراوان ترین مواد شیمیایی آلی تولید شده در صنعت هستند. شاید دو الکل شناخته شده اتانول و متانول (یا متیل الکل) باشند.
اتانول در لوازم بهداشتی، دارویی و سوخت استفاده می شود و برای استریل کردن وسایل بیمارستانی استفاده میشود.
علاوه بر این، الکل موجود در مشروبات الکلی است.
اتر بی حس کننده نیز از اتانول ساخته شده است.
متانول به عنوان یک حلال ، به عنوان ماده اولیه برای ساخت فرمالدئید و رزین های خاص استفاده می شود.، در سوخت های مخصوص، در ضد یخ و برای تمیز کردن فلزات.













